식품의약품안전처는 국내 개발 코로나19 혈장분획치료제 'GC5131'에 대해 2단계 임상시험을 승인했다.
이로써 국내에서 코로나19 관련해 진행하고 있는 치료제와 백신의 임상시험은 모두 16건이 됐다.
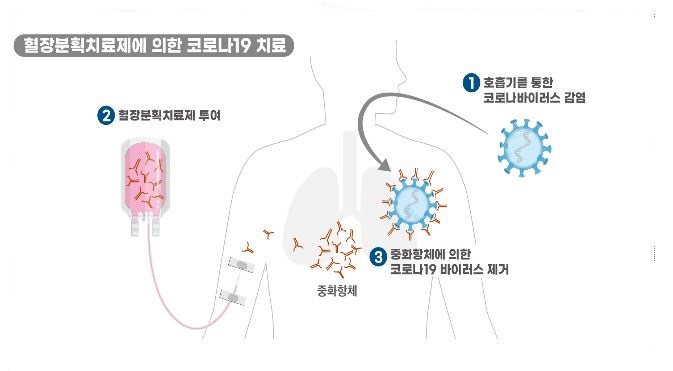
승인한 GC5131은 녹십자에서 코로나19 완치자의 혈장을 이용해 개발 하고 있는 '고면역글로불린(Hyper-immune Globulin)' 성분 의약품이다.
임상시험은 코로나19 환자를 대상으로 안전성과 유효성을 평가하기 위해 진행한다.
해당 제품은 코로나19 완치자의 혈액 가운데 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화한 것으로 코로나19 중화항체가 농축된 면역글로불린이다.
면역글로불린은 혈장 성분 가운데 면역에 중요한 역할을 하는 단백질이다. 식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔다.
원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발돼 사용되고 있어 임상 1상 시험을 면제했다.
국내와 마찬가지로 프랑스와 중국, 일본, 이탈리아도 혈장분획치료제를 개발 하고 있으며, 6개의 소규모 임상시험이 진행이 되고 있다.
식약처 관계자는 "국내 개발 제품의 임상시험 현황에 대해서 신속하게 정보를 전달하도록 하겠다"며 "안전하고 효과 있는 치료제·백신이 신속히 개발될 수 있도록 최대한 지원할 계획"이라고 말했다. ⓒ 세이프타임즈
강보경 기자
bok0269@gmail.com
관련기사
- 코로나19 치료제·백신 생산시설·장비 지원 기업 모집
- 식약처, 코로나19 치료제 'GX-I7' 임상시험 승인
- 고대의료원, 세계 석학과 포스트 코로나 '넥스트 노멀' 예측하다
- 식약처, 백신 생산서 접종까지 관리 가이드라인 마련
- 식약처, 코로나19 치료제 '렘데시비르' 국내 품목허가
- 코로나19 신규확진 258명 … 2주전 보다 13배 증가
- 신천지·이태원보다 '심각' … 신규확진 280명·1명 사망
- 타트체리 '수면유도·면역력 증강·염증제거' 허위광고
- 식약처, 식품위생법 위반 업체 75곳 적발
- 거리두기 3단계 격상 '가짜뉴스' … 사랑제일교회 관련 확진자 933명
- 수도권 확진자 첫 300명 돌파 … 간접흡연도 고위험
- 정은경 본부장 "일일 확진자 2000명 될 수 있다"
- 식약처 의료인 위한 '호흡기 보호구' 규정 신설
- 식약처 의료기 소프트웨어 '안전관리' 체계 마련
- 사랑제일교회 관련 코로나 확진 1083명 … 4660명 격리중
- 식약처, 에스디바이오센서 코로나 진단시약 국내 정식 허가
- 정은경 본부장 "확진자 200명대 진입, 급격한 감소 아니다"
- 식약처 '계절독감백신' 2600만명분 출하 …22일 전까지
- 복지부 코로나19 완치자 혈장 모집 전국 확대
- 코로나19 항체 검사 결과 1440건 가운데 단 '1건' 양성
- 박능후 장관 "안전하고 성공 가능성 높은 백신 확보 노력"
- 녹십자 차세대 대상포진 백신 'CRV-101' 항체 형성 확인
- GC녹십자, 부작용 낮춘 피임약 '디어미순' 마케팅 공모전 성료


