식품의약품안전처는 K-방역 시스템의 핵심인 코로나19 진단시약의 허가‧심사 상황 등에 대한 현황을 15일 발표했다.
코로나19 진단 등을 위해 국내 사용이 가능한 제품은 확진 검사용 긴급사용승인 제품 7개와 응급 선별용 긴급사용승인 9개, 정식허가 1개로 모두 16개다.
수출제품은 166개 제품이 허가돼 16개 제품이 긴급사용승인(FDA EUA) 제품으로 등록돼 있다.
국내 방역에서 사용하고 있는 긴급사용 승인된 코로나19 진단시약은 '분자진단방식'을 사용하는 유전자 진단시약 제품이다. 사용목적에 따라 확진 검사용과 응급 선별 검사용으로 구분된다.
확진검사 제품은 코로나19 감염자의 확진을 목적으로 6시간 안으로 결과를 확인해 진단할 수 있다.
응급 선별검사 제품은 1시간 안으로 결과를 확인할 수 있는 제품이다. 긴급한 수술이 필요한 환자 등 중증응급환자를 대상으로 빠르게 코로나19 음성을 확인하는 목적으로 사용하고 있다.
검사 결과 양성으로 나오면 '확진 검사 제품'으로 재검사해 확진여부를 판단하도록 하고 있다.
식약처는 국내 코로나19 방역활동에 사용하는 진단시약의 품질에 대한 신뢰도를 높이고 안정적인 공급체계를 갖추고자 코로나19 진단시약에 대한 신속한 정식허가가 이루어질 수 있도록 지원방안을 마련했다.
유전자 진단시약과 면역검사 등 18개의 코로나19 진단시약 제품이 임상적 성능시험을 거쳐 정식허가를 신청했고 임상적 성능시험계획 승인을 받은 14개 제품이 성능시험 가운데 있다.
코로나19 진단시약은 검체 안의 바이러스 유무를 확인하는 유전자 진단시약, 항원진단시약과 바이러스에 대한 항체 유무를 확인하는 항체진단시약 등 3종류가 있다.
유전자 진단시약은 환자 검체 안의 바이러스 유전자를 증폭하는 분자진단방식으로 바이러스 유무를 확인해 감염 여부를 진단한다. 과학적으로 가장 정확도가 높아 코로나19 확진용으로 사용하고 있다.
분자진단방식은 비인두와 구인두 가검물 등 환자 검체에 포함된 미량의 바이러스 유전자를 분리하고 증폭해 바이러스 유무를 확인하는 방법이다.
항원 진단시약은 바이러스의 특정 단백질을 인식해 검체 안의 바이러스 유무로 감염 여부를 확인한다. 비인두‧구인두 등 검체를 그대로 사용해 바이러스가 미량이면 검사 결과에 영향을 줄 수 있다.
항체 진단시약은 바이러스 감염에 대한 면역반응으로 만들어진 항체의 생성 유무를 확인하는 제품이다. 항체가 생성되기 이전 초기 감염단계는 음성으로 진단될 수 있고 검사 당시 검체 안의 바이러스 유무를 직접적으로 확인하기에는 어려움이 있다.
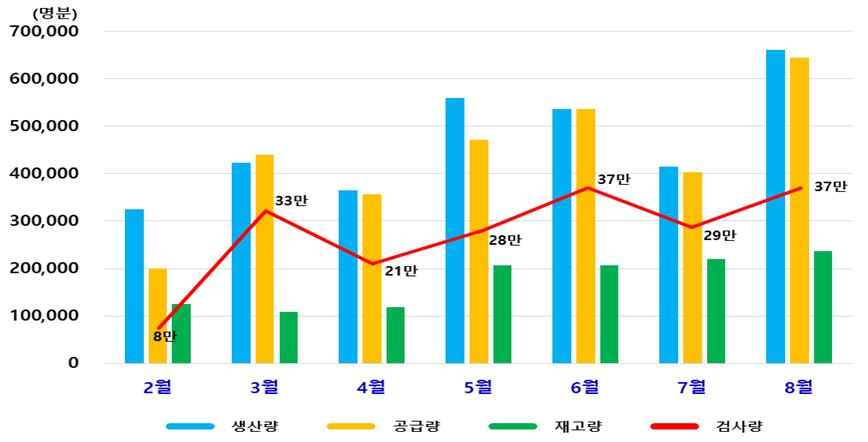
국내 방역에 사용하고 있는 코로나19 진단시약의 1일 최대 생산량은 16만명분이다. 식약처는 359만명분을 생산해 이 가운데 329만명분이 공급됐고 모두 212만건의 검사를 진행했다.
식약처는 "코로나19 진단시약 사용개발 동향 등을 지속적으로 모니터링하고 종사자 교육 강화를 통해 전문성 향상하는 등 품질이 우수한 제품이 개발되고 신속히 허가를 받을 수 있도록 적극적으로 지원하겠다"고 말했다. ⓒ 세이프타임즈
관련기사
- 식약처 "코로나19 백신 개발, 256억원 예산 편성"
- 식약처 '코로나19·독감' 동시진단시약 임상시험 승인
- 식약처-세종충남대병원 의약품연구개발 업무협약
- 식약처, 에스디바이오센서 코로나 진단시약 국내 정식 허가
- 중대본 "추석연휴기간 이동자제, 고속도로 통행료 유료"
- 중대본 "경북 산양삼 사업설명회 4명 추가 전파"
- '의약품 부작용' 피해구제 신청인 권리 대폭 강화된다
- 중대본 "코로나19 확진 153명 증가세 꺾이지 않았다"
- 크릴오일·콜라겐 허위 광고 '수두룩' … 식약처 183건 적발
- 식약처 추석 앞두고 '의약품 표시광고' 집중 점검

